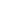Giá bán: Liên hệ
- Xuất xứ: Ý
Qui cách đóng gói: Hộp 5 vỉ, mỗi vỉ 20 viên.
Thành phần: Flunarizin 5mg
Nhóm: Thuốc rối loạn tiền đình
Nhà sản xuất: Janssen (Thụy Sĩ)
Sản xuất tại Ý
Thành phần
Mỗi viên nén SIBELIUM có chứa:
Hoạt chất: Funarizin hydrochlorid 5.89mg tương đương với 5mg Flunarizin.
Tá dược: Lactose monohydrat, tinh bột ngô, hypromellose 2910 15mPa.s, polysorbat 20, cellulose vi tinh thể, natri croscarmellose, silic dioxyd dạng keo khan, và magnesi stearat.
Công dụng (Chỉ định)
Điều trị dự phòng cơn đau nửa đầu trong trường hợp các biện pháp điều trị khác không có hiệu quả hoặc kém dung nạp.
Liều dùng
Người lớn đến 65 tuổi
5mg/ngày, uống vào buổi tối, trong 4 đến 8 tuần.
Trong thời gian điều trị, nếu xuất hiện các triệu chứng trầm cảm, ngoại tháp hay các biến cố bất lợi nghiêm trọng khác, cần ngừng dùng thuốc (xem Cảnh báo và thận trọng).
Nếu sau 8 tuần điều trị không có sự cải thiện, bệnh nhân được xem như không đáp ứng với điều trị và nên ngừng dùng thuốc.
Nếu không đáp ứng lâm sàng đầy đủ, có thể tăng liều lên đến 10mg/ngày nhưng cần cân nhắc trong khả năng dung nạp thuốc.
Thời gian điều trị không quá 6 tháng.
Người cao tuổi trên 65 tuổi
5mg/ngày, uống vào buổi tối, trong 4 đến 8 tuần.
Nếu trong thời gian điều trị, nếu xuất hiện các triệu chứng trầm cảm, ngoại tháp hay các biến cố bất lợi nghiêm trọng khác, cần ngừng dùng thuốc .(xem Cảnh báo và thận trọng).
Nếu sau 8 tuần điều trị không có sự cải thiện, bệnh nhân được xem như không đáp ứng với điều trị và nên ngừng dùng thuốc.
Trẻ em
Thời gian điều trị không quá 6 tháng.
Trẻ em từ 12 tuổi trở lên: với những trường hợp ngoại lệ, khi đau nửa đầu đang có chiều hướng giảm: 5mg/ngày, uống vào buổi tối. Thời gian điều trị không quá 6 tháng.
Trẻ em dưới 12 tuổi: tính an toàn và hiệu quả của Flunarizin chưa được xác nhận. Không khuyến cáo sử dụng Flunarizin cho trẻ em dưới 12 tuổi.
Cách dùng
Nên uống thuốc vào buổi tối, trước khi đi ngủ bởi vì nguy gây cơ buồn ngủ và ngủ gà.
Không sử dụng trong trường hợp sau (Chống chỉ định)
Không dùng thuốc này trong những trường hợp sau:
- Mẫn cảm với Flunarizin hoặc một trong các tá dược của thuốc.
- Có triệu chứng của bệnh Parkinson từ trước khi điều trị (xem Cảnh báo và thận trọng và Tác dụng không mong muốn).
- Tiền sử có các triệu chứng ngoại tháp (xem Cảnh báo và thận trọng và Tác dụng không mong muốn).
- Bệnh trầm cảm hoặc có tiền sử bệnh trầm cảm (xem Cảnh báo và thận trọng và Tác dụng không mong muốn).
Lưu ý khi sử dụng (Cảnh báo và thận trọng)
Do Flunarizin có thể làm tăng các triệu chứng ngoại tháp và trầm cảm và bộc phát hội chứng Parkinson, đặc biệt trên người cao tuổi. Do vậy, nên dùng thận trọng trên các bệnh nhân này.
Không sử dụng thuốc quá liều khuyến cáo. Bệnh nhân cần được khám định kỳ đều đặn, đặc biệt trong thời gian điều trị duy trì để có thể phát hiện sớm các triệu chứng ngoại tháp hay trầm cảm và ngừng điều trị kịp thời.
Triệu chứng ngoại tháp có thể xuất hiện muộn (khoảng 1 năm). Hầu hết các trường hợp không nặng, nhưng có thể tồn tại nhiều tháng sau khi ngừng điều trị (thời gian thoái lui trung bình khoảng 3 tháng). Sự cải thiện có thể không hoàn toàn và có thể cần một liệu pháp điều trị bằng thuốc chống Parkinson. Trong một vài trường hợp, triệu chứng này có thể tồn tại mặc dù đã điều trị.
Các trường hợp hội chứng trầm cảm đã được báo cáo, xuất hiện sau 5 đến 8 tháng kể từ khi bắt đầu điều trị. Các trường hợp này thường không nặng, nhưng trong một vài trường hợp, phải kê đơn thuốc chống trầm cảm cho bệnh nhân hoặc điều trị trong bệnh viện nếu cần.
Bệnh nhân có thể tăng cân khi điều trị với Flunarizin. Trong các trường hợp hiếm gặp mệt mỏi có thể gia tăng trong thời gian điều trị với Flunarizin: nếu tình trạng này xảy ra, cần ngừng điều trị.
Thuốc này có chứa lactose. Bệnh nhân được khuyên không nên dùng thuốc trong trường hợp không dung nạp với galactose, thiếu men tiêu hóa lactose (Lapp lactase) hoặc mắc hội chứng rối loạn hấp thu glucose-galactose (bệnh di truyền hiếm gặp).
Tác dụng không mong muốn (Tác dụng phụ)
Tính an toàn của SIBELIUM được đánh giá trên 247 bệnh nhân tham gia vào 2 thử nghiệm có kiểm chứng giả dược, một thử nghiệm trong điều trị đau nửa đầu, một thử nghiệm trong điều trị chóng mặt và trên 476 bệnh nhân được điều trị bằng Flunarizin tham gia vào 2 thử nghiệm có kiểm soát với 1 chất so sánh có hoạt tính được sử dụng trong điều trị chóng mặt và/hoặc đau nửa đầu (chỉ định trong điều trị chóng mặt đã bị thu hồi bởi bất lợi trong tỷ lệ lợi ích và nguy cơ).
Dựa trên dữ liệu an toàn gộp từ các thử nghiệm lâm sàng, phản ứng bất lợi củấ thuốc được báo cáo thường gặp nhất (biến cố ≥ 4) là: tăng cân (11%), buồn ngủ (9%), trầm cảm (5%), tăng cảm giác thèm ăn (4%), và viêm mũi (4%),
Bảng dưới đây trình bày tất cả các tác dụng không mong muốn được báo cáo khi sử dụng SIBELIUM trong các thử nghiệm lâm sàng (bao gồm các biến cố bất lợi phần trên) và trong quá trình lưu hành thuốc trên thị trường. Các tần suất sau đây được quy ước:
Rất thường gặp >1/10.
Thường gặp >1/100 đến <1/10.
Ít gặp >1/1000 đến <1/100.
Hiếm gặp >1/10000 đến <1/1000.
Rất hiếm gặp <1/10000.
Không được biết: không ước tính được từ các dữ liệu lâm sàng hiện có.
|
Hệ thống |
Các phản ứng bất lợi của thuốc |
|||
|
Phân loại tần suất |
||||
|
Rất thường gặp (>1/10) |
Thường gặp (>1/100 đến <1/10) |
Ít gặp (> 1/1 000 đến <1/100) |
Không được biết |
|
|
Nhiễm khuẩn và nhiễm ký |
|
Viêm mũi |
|
|
|
Rối loạn chuyển hóa và dinh dưỡng |
|
Tăng cảm giác thèm ăn |
|
|
|
Rối loạn tâm thần |
|
Trầm cảm, |
Hội chứng trầm cảm (xem Cảnh báo và thận trọng); Rối loạn giấc ngủ; Lãnh đạm; Lo lắng |
|
|
Rối loạn hệ thần kinh |
|
Ngủ gà |
Bất thường phối hợp vận động; mất định hướng; ngủ lịm; dị cảm; bồn chồn không yên; chậm chạp; uể oải; ù tai; vẹo cổ |
Chứng bồn chồn đứng ngồi không yên; vận động chậm chạp; cứng cơ dạng bánh xe răng cưa; rối loạn vận động; run nguyên phát; rối loạn ngoại tháp (xem Cảnh báo và thận trọng); hội chứng Parkinson; buồn ngủ; run |
|
Rối loạn tim |
|
|
Hồi hộp đánh trống ngực |
|
|
Rối loạn mạch |
|
|
Hạ huyết áp |
|
|
Rối loạn hệ tiêu hóa |
|
Táo bón; Khó chịu ở dạ dày; buồn nôn |
Tắc ruột; khô miệng; rối loạn dạ dày, ruột |
|
|
Rối loạn gan mật |
|
|
|
Tăng men gan |
|
Rối loạn da và mô dưới da |
|
|
Tăng tiết mồ hôi |
Phát ban |
|
Rối loạn cơ xương và toàn thân |
|
Đau cơ |
Co thắt cơ; giật cơ |
Cứng cơ |
|
Rối loạn hệ sinh sản và vú |
|
Kinh nguyệt không đều; đau vú |
Rong kinh; rối loạn kinh nguyệt; thưa kinh; phì đại tuyến vú; giảm khả năng tình dục |
Tăng tiết sữa |
|
Rối loạn toàn thân và tình trạng tại nơi dùng thuốc |
|
Mệt mỏi |
Phù nề toàn thân; phù nề ngoại vi; suy nhược |
|
|
Các chỉ số khác |
Tăng cân |
|
|
|
Báo cáo các phản ứng bất lợi nghi ngờ
Báo cáo các phản ứng bất lợi nghi ngờ sau khi thuốc được lưu hành là rất quan trọng. Điều này cho phép tiếp tục kiểm soát cân bằng yếu tố lợi ích và nguy cơ của thuốc. Bác sỹ được yêu cầu báo cáo bất kỳ các phản ứng bất lợi nào tới Trung tâm Quốc Gia và Trung tâm khu vực về thông tin thuốc và theo dõi phản ứng bất lợi của thuốc.
Thông báo cho bác sỹ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
Tương tác với các thuốc khác
Các kết hợp cần lưu ý
Các thuốc atropinic
Cân nhắc khi sử dụng các hoạt chất atropinic có thể làm tăng tác dụng không mong muốn của các thuốc này và tăng nguy cơ bí tiểu, tăng nhãn áp cấp tính, táo bón, khô miệng, v.v.
Các thuốc atropinic khác nhau bao gồm các thuốc chống trầm cảm Imipraminic, hầu hết các thuốc kháng histamin H1, thuốc điều trị Parkinson kháng cholinergic, thuốc chống co thắt Atropinic, Disopyramid, thuốc an thần kinh Phenotiazinic và Clozapin.
Các thuốc an thần
Cân nhắc khi sử dụng các thuốc hoặc hoạt chất có thể làm tăng tác dụng an thần của chúng trên hệ thống thần kinh trung ương và góp phần làm giảm cảnh giác. Ví dụ như các dẫn xuất morphin (điều trị giảm đau, chữa ho và điều trị thay thế), thuốc an thần kinh, các thuốc nhóm barbituric, các thuốc nhóm benzodiazepin, các thuốc giải lo âu khác không thuộc nhóm benzodiazepin (ví dụ Méprobamat), thuốc ngủ, thuốc chống trầm cảm có tác dụng an thần (Amitriptylin, Doxépin, Mianserin, Mirtazapin, Trimipramin), thuốc kháng histamin H1 có tác dụng an thần, thuốc điều trị tăng huyết áp tác dụng lên thần kinh trung ương, Baclofen và Thalidomid.
Các kết hợp không được khuyến cáo
Rượu/cồn:
Rượu/còn làm tăng tác dụng an thần. Mức độ suy giảm của ý thức có thể gây nguy hiểm khi lái xe và sử dụng máy móc. Tránh dùng các đồ uống có rượu/cồn và các thuốc chứa rượu/cồn.
Các kết hợp khác
Topiramat
Dược động học của Flunarizin không bị ảnh hưởng bởi Topiramat. Trong thời gian sử dụng đồng thời Flunarizin và Topiramat 50mg mỗi 12 giờ, nồng độ Flunarizin trong cơ thể tăng 16% ở bệnh nhân đau nửa đầu so với 14% ở những bệnh nhân chỉ điều trị với Flunarizin. Ở nồng độ hằng định, dược động học của Topiramat không bị ảnh hưởng bởi Flunarizin.
Tính tương kỵ
Chưa ghi nhận.
Bảo quản
Bảo quản ở nhiệt độ không quá 25oC.
Lái xe
Ngủ gà có thể xảy ra trên người lái xe hoặc vận hành máy móc, đặc biệt trên bệnh nhân mới bắt đầu điều trị hoặc kết hợp đĩều trị với thuốc này.
Thai kỳ
Phụ nữ có thai
Chưa có dữ liệu về việc sử dụng Flunarizin trên phụ nữ có thai. Các nghiên cứu trên động vật không chứng tỏ tác động có hại trực tiếp hay gián tiếp trên sinh sản, phát triển của phôi hoặc thai, về tiến trình thai nghén hoặc sự phát triển chu sinh và hậu sản.
Khi không có tác động gây quái thai trên động vật, có thể không gặp dị tật trên người. Thực tế, cho đến nay, các hoạt chất gây dị tật trên người đã cho thấy tác động gây quái thai trên động vật trong suốt các nghiên cứu hợp thức được tiến hành trên cả hai loài.
Do đó, để thận trọng, tốt hơn Flunarizin không nên được sử dụng trong suốt thai kỳ.
Phụ nữ cho con bú
Chưa được biết liệu Flunarizin có bài tiết vào trong sữa hay không. Nghiên cứu trên động vật cho thấy có sự bài tiết Flunarizin vào trong sữa. Việc quyết định ngừng cho bú hoặc tiếp tục/ngừng điều trị với Flunarizin phải được cân nhắc dựa trên yếu tố lợi ích của trẻ bú mẹ với lợi ích điều trị cho người mẹ.
Đóng gói
Hộp chứa 5 vỉ, mỗi vỉ chứa 20 viên nén.
Hạn dùng
2 năm kể từ ngày sản xuất.
Quá liều
Một vài trường hợp quá liều nặng được báo cáo (liều trên 600mg).
Triệu chứng chính được quan sát là: buồn ngủ, kích động và nhịp tim nhanh.
Điều trị bao gồm uống than hoạt tính, điều trị triệu chứng.
Không có thuốc giải độc đặc hiệu.
Dược lực học
NHÓM THUỐC ĐIỀU TRỊ ĐAU NỬA ĐẦU KHÁC.
Mã ATC: N02CX
(N: hệ thần kinh trung ương)
Flunarizin là thuốc kháng histamin H1, kháng dopaminergic và kháng cholinergic. Flunarizin là thuốc đối kháng calci có chọn lọc. Tác dụng của nó trong đỉểu trị duy trì chứng đau nửa đầu được dựa trên sự đối lập có chọn lọc các ion calci vào trong tế bào.
Flunarizin không tác động trên khả năng co bóp và sự dẫn truyền cơ tim.
Dược động học
Flunarizin được hấp thu tốt, đạt nồng độ đỉnh trong huyết tương trong vòng 2 - 4 giờ và đạt trạng thái ổn định ở tuần thứ 5-6.
Hấp thu
Flunarizin hấp thu tốt tại đường tiêu hóa (> 80%), đạt nồng độ đỉnh trong huyết tương trong vòng 2 đến 4 giờ sau khi uống. Trong điều kiện acid dạ dày giảm (nồng độ pH dạ dày cao hơn), sinh khả dụng của Flunarizin có thể thấp hơn ở mức vừa phải.
Phân bố
Flunarizin gắn kết protein huyết tương > 99%. Thể tích phân bố lớn, khoảng 78L/kg ở những người khỏe mạnh và khoảng 207L/kg ở những bệnh nhân động kinh chứng tỏ khả năng phân bố cao ở các mô ngoài mạch máu. Thuốc nhanh chóng qua hàng rào máu não, nồng độ ở não gấp khoảng 10 lần so với nồng độ trong huyết tương.
Chuyển hóa
Flunarizin được chuyển hóa ở gan thành ít nhất 15 chất chuyển hóa. Đường chuyển hóa chính là CYP2D6.
Thải trừ
Flunarizin thải trừ chủ yếu qua phân theo đường mật dưới dạng thuốc gốc và các chất chuyển hóa. Trong vòng 24 - 48 giờ sau khi uống, có khoảng 3% đến 5% liều được thải trừ qua phân dưới dạng thuốc gốc và các chất chuyển hóa, và < 1% được bài tiết ở dạng không chuyển hóa trong nước tiểu. Thời gian bán hủy của thuốc thay đổi nhiều trong khoảng từ 5 - 15 giờ ở hầu hết các bệnh nhân sau khi dùng liều đơn. Ở một số người cho thấy nồng độ huyết tương của flunarizin có thể đo lường được (> 0.5 ng/mL) trong thời gian kéo dài (cho đến 30 ngày), điều này có thể do sự tái phân bố thuốc từ các mô khác.
Đa liều
Nồng độ huyết tương của Flunarizin đạt được trạng thái ổn định sau khoảng 8 tuần đa liều dùng một lần mỗi ngày, và cao hơn nồng độ huyết tương của Flunarizin sau khi dùng một liều đơn khoảng 3 lần. Nồng độ Flunarizin ở trạng thái ổn định tương ứng với khoảng liều thay đổi từ 5mg - 30mg.
Đặc điểm
Viên nén thuôn màu trắng với vết khắc “J-C” trên một mặt và “FL 5” trên mặt còn lại.
Nghiên cứu tiền lâm sàng
Trong các nghiên cứu tiền lâm sàng, ảnh hưởng trên hệ thần kinh trung ương được quan sát thấy chỉ khi dùng ở nồng độ cao so với nồng độ tối đa trên người, điều này ít có ý nghĩa lâm sàng.
Trong một nghiên cứu độc tính đơn liều, liều gây chết trung bình (LD50) là 960 - 1896mg/kg và 343 - 1935mg/kg tương ứng trên chuột nhắt và chuột cống. Các nghiên cứu liều độc lặp lại trên chuột cống và chó đã chỉ ra ảnh hưởng lâm sàng trên hệ thần kinh trung ương (bao gồm: buồn ngủ và tăng tiết nước bọt trên chuột cống, co đồng tử, sự giãn ra của màng nháy, mất điều hòa, run, căng cơ, kiệt sức, rung giật cơ, và bất thường các cử động đầu ở chó), điều này là do tăng ảnh hưởng dược lý, tuy nhiên, nhìn chung những ảnh hưởng này được quan sát thấy có liên quan đến mức liều nói trên (khoảng 400 lần liều điều trị tối đa trên người tính theo mg/kg).
Trong các nghiên cứu trên hệ sinh sản, không quan sát thấy ảnh hưởng trên khả năng sinh sản, hoặc gây quái thai. Tuy nhiên khi dùng ở mức liều cao (khoảng 150 - 400 lần liều điều trị tối đa trên người tính theo mg/kg), độc tính thứ phát trên bào thai dẫn đến độc tính trên sinh sản đã được quan sát thấy. Flunarizin không gây đột biến cũng như không gây ung thư. Ảnh hưởng nhỏ được quan sát trên chuột, nhưng chỉ khi dùng liều độc, trên sự phát triển của tuyến vú và sự xuất hiện của các khối u liên quan đến prolactin (khoảng 50 - 100 lần liều điều trị tối đa trên người tính theo mg/kg).
Thông tin khác
Thuốc này dùng theo đơn của bác sỹ.
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Để xa tầm tay trẻ em.
Thông báo cho bác sỹ hoặc dược sỹ các tác dụng không mong muốn gặp phải khi sử dụng thuốc.